Diferencias entre un sólido molecular y un sólido reticular: Todo lo que debes saber
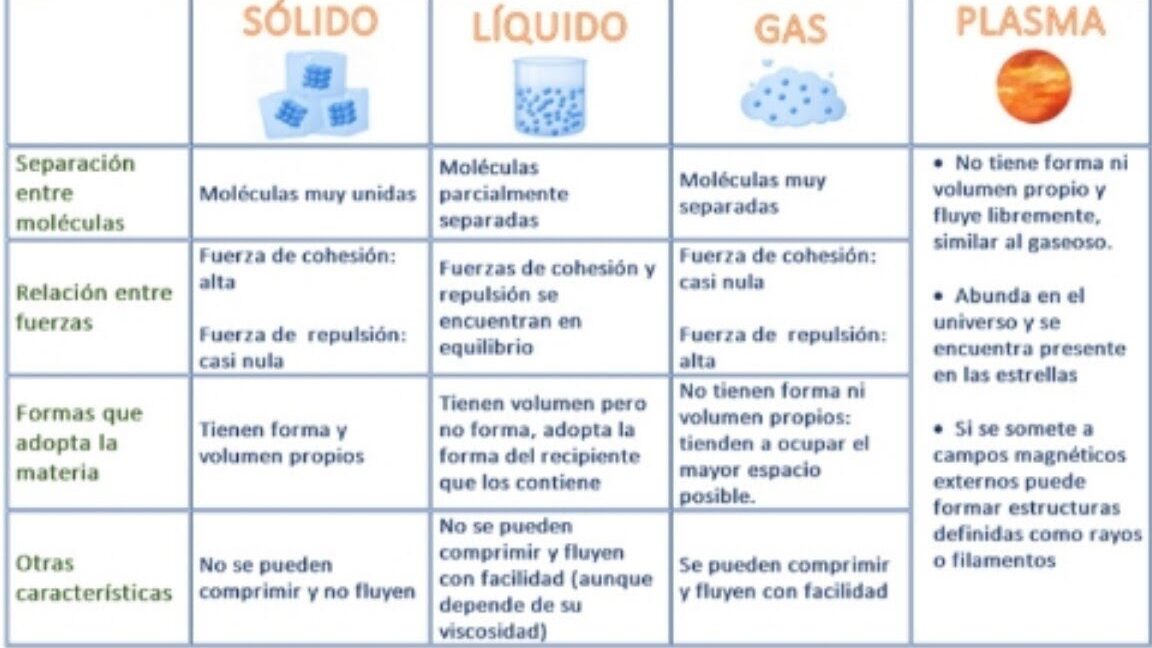
El estudio de los diferentes tipos de sólidos es fundamental en el campo de la química. Dos de los tipos más comunes de sólidos son los sólidos moleculares y los sólidos reticulares. Aunque tienen algunas similitudes, también presentan diferencias significativas que es importante comprender. En este artículo, exploraremos en detalle las características y propiedades de estos dos tipos de sólidos, y también analizaremos las principales diferencias entre ellos. Si deseas profundizar tus conocimientos sobre el tema, ¡sigue leyendo!
Sólido molecular
Los sólidos moleculares están formados por moléculas que se unen mediante enlaces químicos covalentes. Estas moléculas pueden ser simples o compuestas, y se mantienen juntas debido a las fuerzas intermoleculares, como los puentes de hidrógeno, las fuerzas de London y las fuerzas dipolo-dipolo. Estas fuerzas intermoleculares son más débiles que los enlaces covalentes en sí, lo que da como resultado sólidos con puntos de fusión y ebullición relativamente bajos.
Una característica distintiva de los sólidos moleculares es que son suaves y blandos, o bien frágiles y quebradizos. Esto se debe a que las moléculas están dispuestas de manera desordenada en la estructura sólida, lo que resulta en una falta de cohesión y rigidez. Por ejemplo, el hielo es un sólido molecular que se funde fácilmente a temperaturas cercanas a los 0 grados Celsius.
Algunos ejemplos comunes de sólidos moleculares incluyen el azúcar, el hielo, la cera y el dióxido de carbono sólido (conocido como hielo seco).
Sólido reticular
Los sólidos reticulares, también conocidos como sólidos covalentes reticulares o sólidos de red covalente, se forman cuando los átomos se unen mediante enlaces covalentes en una estructura tridimensional. A diferencia de los sólidos moleculares, en los sólidos reticulares no se pueden distinguir o diferenciar moléculas y el sólido forma una red cristalina.
En los sólidos reticulares, los átomos están dispuestos en un arreglo repetitivo y ordenado que se extiende en todas las direcciones. Esto confiere a los sólidos reticulares una mayor rigidez y resistencia, lo que los hace más duros y menos susceptibles a la ruptura que los sólidos moleculares.
Algunos ejemplos de sólidos reticulares incluyen el diamante, el grafito, el carburo de silicio y el cuarzo. Estos sólidos son conocidos por sus propiedades físicas y químicas particulares, y se utilizan en una variedad de aplicaciones, desde la fabricación de joyas hasta la electrónica.
10 Diferencias entre sólidos moleculares y sólidos reticulares
- Los sólidos moleculares están formados por moléculas discretas, mientras que los sólidos reticulares están formados por una red de átomos unidos por enlaces covalentes.
- Los sólidos moleculares tienden a tener puntos de fusión y ebullición relativamente bajos debido a las fuerzas intermoleculares más débiles. Por otro lado, los sólidos reticulares tienen puntos de fusión y ebullición más altos debido a los enlaces covalentes fuertes y a la estructura tridimensional ordenada.
- Los sólidos moleculares son suaves y blandos, o bien frágiles y quebradizos, debido a la falta de cohesión y rigidez en su estructura. En cambio, los sólidos reticulares son duros y rígidos debido a su estructura cristalina ordenada.
- Los sólidos moleculares a menudo tienen propiedades eléctricas y térmicas pobres, ya que las moléculas no pueden moverse fácilmente para conducir el calor o la electricidad. Por otro lado, los sólidos reticulares pueden tener propiedades eléctricas y térmicas tanto conductoras como aislantes, dependiendo de su estructura y composición.
- Los sólidos moleculares son generalmente solubles en solventes polares, ya que las moléculas pueden ser atraídas y separadas por las fuerzas intermoleculares del solvente. Por otro lado, los sólidos reticulares son insolubles en solventes polares debido a los fuertes enlaces covalentes en su estructura.
- Los sólidos moleculares pueden experimentar cambios de fase a temperaturas y presiones relativamente bajas, como la sublimación o la descomposición. Por otro lado, los sólidos reticulares son más estables y tienen puntos de fusión y ebullición más altos.
- Los sólidos moleculares son más fácilmente deformables debido a la falta de rigidez en su estructura. Los sólidos reticulares, por otro lado, son menos deformables debido a su estructura cristalina ordenada y su mayor rigidez.
- Los sólidos moleculares son considerados como materiales suaves y flexibles, mientras que los sólidos reticulares son más rígidos y quebradizos.
- Los sólidos moleculares tienen baja densidad en comparación con los sólidos reticulares, ya que las moléculas están menos densamente empaquetadas. Los sólidos reticulares, por otro lado, tienden a tener una densidad más alta debido a su estructura tridimensional ordenada.
- Los sólidos moleculares son más fáciles de vaporizar y convertir en estado gaseoso, ya que las moléculas pueden separarse con menor energía. Por otro lado, los sólidos reticulares requieren una mayor cantidad de energía para romperse y convertirse en gas.
Conclusiones finales
En conclusión, los sólidos moleculares y los sólidos reticulares son dos tipos de sólidos con características y propiedades diferentes. Los sólidos moleculares están formados por moléculas unidas mediante fuerzas intermoleculares, mientras que los sólidos reticulares están formados por átomos unidos mediante enlaces covalentes en una estructura tridimensional ordenada.
Estas diferencias en la estructura y las fuerzas que mantienen juntas a las partículas en los sólidos resultan en propiedades y comportamientos distintos. Los sólidos moleculares tienden a ser suaves, blandos y frágiles, con puntos de fusión y ebullición relativamente bajos. Por otro lado, los sólidos reticulares son más duros, rígidos y tienen puntos de fusión y ebullición más altos debido a sus enlaces covalentes fuertes y su estructura cristalina ordenada.
Es importante entender estas diferencias para aplicaciones prácticas en diversos campos, como la industria, la investigación y el desarrollo de materiales. Tanto los sólidos moleculares como los sólidos reticulares tienen sus propias ventajas y desventajas, y su elección depende del uso previsto y las propiedades requeridas.
En resumen, los sólidos moleculares y los sólidos reticulares son dos entidades químicas con características distintas. Conocer sus diferencias es esencial para comprender cómo se comportan y cómo pueden ser utilizados en diferentes aplicaciones. Asimismo, comprender las propiedades y la estructura de estos sólidos nos permite tener una visión más clara del mundo de la química y su importancia en nuestras vidas.





¿Que te han parecido estas diferencias?